用试管取适量碳酸氢钠溶液,滴加酚酞试液,振荡,溶液变浅红色。
结论:。
取适量碳酸氢钠加入试管中,滴加稀盐酸,再把燃着的木条迅速伸入试管,木条熄灭,碳酸氢钠和盐酸的化学反应方程式:。
【探究实验3】能与碱反应
查阅资料:NaHCO3+NaOH═Na2CO3+H2O;氢氧化钙微溶于水.用试管取适量碳酸氢钠溶液,滴加氢氧化钠溶液,无明显现象.(提示:可以选择CaCl2溶液做试剂,通过证明有Na2CO3生成,从而证明二者发生了反应)如图,两位同学分别进行了甲、乙两个实验。回答下列问题:
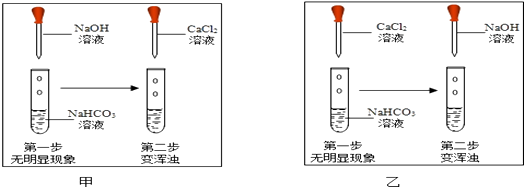
比较甲、乙两个实验的目的性区别是;
有同学提出两个实验都不足以证明有Na2CO3生成,其理由是;要证明有Na2CO3生成,还需要进行的操作是。
【查阅资料】通过对市场上相关产品进行调查,小亮发现了如下图所示的三种商品:

取少量白色粉末于试管中,加入适量蒸馏水,发现白色粉末溶解,无其他明显现象,实验结论是;另取少量白色粉末于试管中,加入 , 有无色气体产生,鲍创认为白色粉末是纯碱。
性质 | 碳酸钠 | 碳酸氢钠 |
溶解性 | 20℃时溶解度21.6g,溶解时放热 | 20℃时溶解度9.8g,溶解时放热 |
加热 | 不分解 | 发生分解反应,分解产物为碳酸钠、二氧化碳和水. |
根据上面信息,检验白色粉末的方法之一是:20℃时,在100克水中加入12克该白色粉末,充分溶解后,如果有白色固体剩余,则为。