 B . 塞紧橡胶塞
B . 塞紧橡胶塞  D . 稀释浓硫酸
D . 稀释浓硫酸 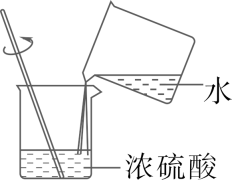


| A.化学与健康 | B.化学与环境 |
| ①碘、铁、锌是人体必需的微量元素 ②人体缺钙会引起贫血 ③糖类、油脂、维生素是人体主要供能物质 | ①广泛使用新能源可以有效减少碳排放 ②乱扔塑料可能引起白色污染 ③煤燃烧产生的二氧化硫易形成酸雨 |
| C.化学与安全 | D.化学与材料 |
| ①点燃氢气前,一定要检验纯度 ②煤气泄漏应立即打开排气扇抽气 ③用煤炉取暖时,放置水能防止CO中毒 | ①塑料、棉花和合成橡胶属于合成材料 ②生铁、四氧化三铁和黄金属于金属材料 ③玻璃钢和钢筋混凝土属于复合材料 |
| 选项 | 实验目的 | 实验设计 |
| A | 除去氯化钠溶液中三种可溶性杂质MgCl2、Na2SO4和CaCl2 | 依次加过量的氢氧化钡、碳酸钠溶液,过滤,再向滤液中加入适量的稀盐酸 |
| B | 证明硫酸与氢氧化钠反应后,硫酸过量 | 取样,加入硝酸钡溶液,观察现象 |
| C | 除去H2中混有的HCl气体 | 将气体通过盛有碳酸钠溶液的洗气瓶洗气 |
| D | 鉴别NaOH溶液和Na2CO3溶液 | 取样,分别加入酚酞试液,观察现象 |



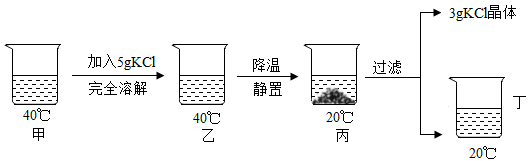
①a点时,溶液中所含溶质为HCl、NaCl(酚酞除外)
②从b点到c点,溶液的pH逐渐变大
③c点时,溶液为无色
④实验说明该反应为放热反应
⑤比较溶液中离子数目多少:a=b<c


若选用图①和图②进行实验,可观察到的现象为。若选用图③进行实验,X与Y溶液能发生反应,其反应的化学方程式为。由实验四可得出结论:金属活动性强弱为:Al>Cu。
①用如图所示充满空气的医用塑料袋收集二氧化碳,则二氧化碳应从(填“a”或“b”)端通入。

②将产生的CO2通入澄清石灰水溶液,未出现浑浊现象,可能的原因是。

查阅资料:①
②
实验设计:取铜样品(假设除铜和铜绿外,不含其它物质),设计甲、乙两方案。
方案甲:

操作Ⅰ、Ⅱ、Ⅲ的名称是,该操作中都要用到玻璃棒,其作用是。
①根据方案甲中数据可知,铜样品中单质铜的质量分数为(小数点保留到0.1%)。
②利用方案乙还原16.0g黑色固体A,得到Cu和Cu2O的混合物共ag。则a的取值范围为<a<14.4g。
反思评价:
向烧杯中加入136g过氧化氢溶液,再向其中加入2g二氧化锰,至不再产生气泡为止,测得烧杯中剩余物质总质量为134.8g。
计算:①生成氧气的质量是g(不考虑氧气在水中的溶解)。
②过氧化氢溶液中溶质的质量分数是多少?