

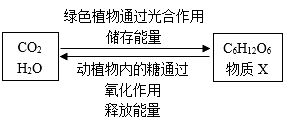


资料:①Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金;
②MgH2和HCl反应的化学方程式为MgH2+2HCl=MgCl2+ 2H2↑。

|
选项 |
甲物质 |
乙物质 |
|
A |
水 |
氢气 |
|
B |
稀盐酸 |
氢氧化钙溶液 |
|
C |
铜单质 |
氧化铜 |
|
D |
氯化钙溶液 |
碳酸钙固体 |
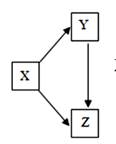
|
X |
Y |
Z |
|
|
A |
CO2 |
CaCO3 |
Na2CO3 |
|
B |
Al |
Al2O3 |
Al2(SO4)3 |
|
C |
AgNO3 |
NaNO3 |
AgCl |
|
D |
H2SO4 |
CuSO4 |
Cu(OH)2 |
甲:只用水,就有办法鉴别NH4NO3、NaOH、CaCO3和NaCl四种固体;
乙:利用CO2气体就能区分NaOH、Ca(OH)2和稀盐酸三种溶液;
丙:有酚酞和BaCl2溶液,就能鉴别盐酸、硫酸、Na2CO3、NaOH和KNO3五种溶液;
丁:不用其它任何试剂就能将HCl、BaCl2、Na2CO3、NaCl四种溶液鉴别出来。
下列有关这些方案的评价正确的是( )


请回答下列有关问题:
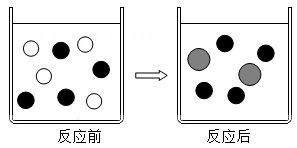


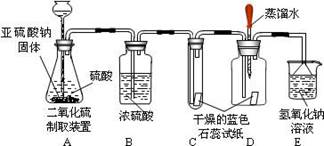
⑴做出假设;
⑵设计方案,实验装置和药品如图:
⑶查阅资料:该实验小组查阅到:①二氧化硫易溶于水,②酸能使湿润的蓝色石蕊试纸变红,③SO2不与浓硫酸反应,④二氧化硫有毒,能与氢氧化钠溶液反应。
⑷实验:①在二氧化硫气体生成之前,装置 D 中胶头滴管中的蒸馏水滴到蓝色石蕊试纸上,未见试纸颜色发生变化,这说明。
② 实验过程中当有二氧化硫气体通过时, 装置 C 内石蕊试纸的颜色始终没有变化, 此现象说明;装置 D 内滴入蒸馏水的石蕊试纸变红,此现象说明。
③装置 E 的作用是
⑸结论。
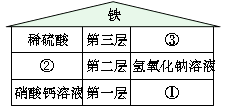
【提出问题】白色固体的成分是什么?
【建立假设】猜想一:白色固体的成分是氧化钠。
猜想二:白色固体的成分是碳酸钠。
猜想三:白色固体的成分是氧化钠和碳酸钠的混合物。
猜想四:白色固体的成分是碳酸钙。
【进行实验】步骤一:取适量白色固体于烧杯中并加入适量水,固体全部溶解,形成无色溶液。
步骤二:往步骤一中生成的溶液中滴加氢氧化钙溶液,出现白色沉淀,继续滴加氢氧化钙溶液直至白色沉淀不再产生,将其过滤。
步骤三:用pH试纸检测步骤二中获得的滤液的pH,结果呈碱性。
【查阅资料】氧化钠和水反应生成氢氧化钠(化学方程式:Na2O+H2O=2NaOH)

Ⅰ、取样品 20g,倒入容积为200mL的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1
Ⅱ、打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2
Ⅲ、实验数据如下表:
反应前总质量 m1 | 反应后总质量 m2 |
371.84g | 371.24g |
回答下列问题:
A.向锥形瓶中倒入样品时,撒出了部分粉末;B.在反应过程中有水蒸气逸出
C.没有等装置中氢气全部排尽就称量

|
第1次 |
第2次 |
第3次 |
第4次 |
|
|
加入稀硫酸质量(g) |
200 |
200 |
200 |
200 |
|
剩余固体质量(g) |
37.6 |
15.2 |
4 |
4 |
并画出反应生成的氢气质量与加入稀硫酸质量的关系图.

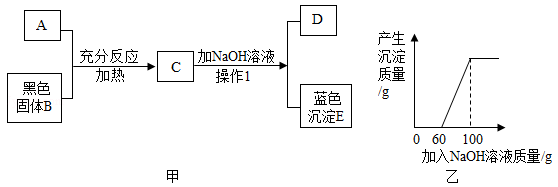
样 品 | 第 1 份 | 第2份 | 第3份 | 第4份 |
取样品质量(g) | 25.0 | 25.0 | 25.0 | 25.0 |
取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
产生气体质量(g) | 0.2 | 0.4 | 0.5 | m |
试计算: