 连接仪器 B .
连接仪器 B . 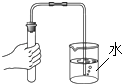 检查气密性 C .
检查气密性 C .  取用石灰石 D .
取用石灰石 D . 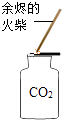 验满
验满  干燥CO2 B .
干燥CO2 B .  收集O2 C .
收集O2 C .  验证CO2性质 D .
验证CO2性质 D .  监控气体流速
监控气体流速 根据实验内容回答问题。
A B C
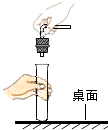
(1)图A铁丝在氧气中剧烈燃烧, , 放出大量的热,有黑色固体生成。该反应的化学方程式为 。
(2)图B装置用于制取氧气,反应的化学方程式为 ,除图中所示的方法外,在实验室中氧气还可用 (用化学反应方程式表示)方法制取。
(3)用稀盐酸和大理石在C装置中反应制CO2 , 反应的化学方程式为 ;并验证CO2有关性质,观察到烧杯中导管口有气泡冒出,但无其他明显现象。若证明CO2与NaOH溶液发生了化学反应,以下方案合理的是 (填序号)。
① 取少量烧杯中液体滴加无色酚酞
② 取少量烧杯中液体滴加足量稀盐酸
③ 取少量烧杯中液体滴加足量石灰水
请根据下图回答问题。
A B C D E
⑴ 实验仪器a的名称是。
⑵ 实验室用高锰酸钾制取氧气的化学方程式为。实验室制备氧气并用排水法收集的操作,下列叙述正确的是(填数字序号)。
①先检查装置的气密性,再加入药品进行制取
②先均匀加热,再对着药品部位集中加热
③先等导管口排出的气泡均匀后,再将导管伸入盛水的集气瓶中进行收集
④先熄灭酒精灯,再将导管从水槽中取出
⑶实验室用大理石和稀盐酸制取二氧化碳化学方程式为,所选用的发生和收集装置分别为(填字母序号),证明二氧化碳已经收集满的方法是 。
实验室部分仪器或装置如图1所示,请回答下列问题

(l)写出指定仪器的名称:A , B .
(2)若要组装一套二氧化碳的发生和收集装置,可选择图1中的 .(填标号)使用该装置还可以制取的气体是 , 应选择的药品是 .
(3)若用高锰酸钾制取氧气,你认为还需增加的仪器是 ,写出用高锰酸钾制取氧气的化学方程式: .用图2所示装置收集氧气,氧气应从 (填“a”或“b”)端导入.
(4)要鉴别氧气和二氧化碳,可选择 .
A.无色酚酞溶液 B.紫色石蕊溶液 C.澄清石灰水 D.燃着的木条.
如图所示,某校同学进行的金属铜冶炼原理的探究,请完成下列填空.

查阅资料:Cu2(OH)2CO3受热易分解生成氧化铜和水同时放出二氧化碳,氢气可以还原氧化铜得到金属铜.
如图所示为实验室中常见的气体制备、干燥、净化和收集实验的部分仪器,试根据题目要求,回答下列问题: 
①所选仪器的连接顺序为:.
②生成氢气时,发生反应的化学方程式为.
③经测定,装置A中锌粒和稀硫酸反应后溶液的pH7(填“变大”“变小”“不变”之一).
①根据完全反应后的C装置的质量变化测定CuO的质量分数,若测得C处大玻璃管内的物质总质量增加bg,则混合物样品中CuO的质量分数(计算结果可为a和b表示的代数式)
②若C处大玻璃管中红色的固体还没有完全消失就测定,则样品CuO的质量分数的测算结果将(填“偏大”“偏小”“不受影响”之一).
③二氧化锰是H2O2溶液制氧气反应的 ,反应后的二氧化锰还可以进行回收重复利用,可采用的操作方法是 ,洗涤,干燥.
科学的核心是研究,科学课程通过科学探究的方式,让我们亲历科学活动,体现科学的发现过程和方法.
已知:二氧化碳气体既不溶于饱和NaHCO3溶液也不与NaHCO3反应;NaHCO3+HCl═NaCl+H2O+CO2↑.某学生欲用浓盐酸与大理石反应制取干燥纯净的二氧化碳气体,实验室提供了下列装置和药品.请回答相关问题:
