物质 | 杂质 | 除杂质应选用的试剂和操作方法 | |
A | N2 | O2 | 铁丝,点燃 |
B | CaO | CaCO3 | 高温煅烧 |
C | KNO3溶液 | KOH溶液 | 加适量的CuSO4溶液,过滤 |
D | FeSO4溶液 | CuSO4溶液 | 加过量的铁粉,过滤 |
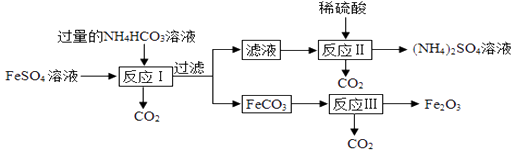
资料:FeCO3 FeO+CO2↑,4FeO+O2=2Fe2O3;
FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑
下列说法正确的是( )
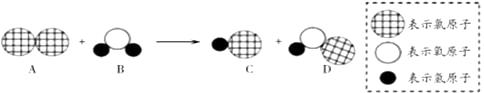
 B . 向黄铜粉末(锌铜混合物)中加稀盐酸
B . 向黄铜粉末(锌铜混合物)中加稀盐酸 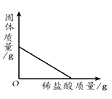 C . 红磷在盛有空气的密闭容器中燃烧
C . 红磷在盛有空气的密闭容器中燃烧 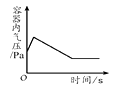 D . 加热一定量的氯酸钾和二氧化锰固体混合物
D . 加热一定量的氯酸钾和二氧化锰固体混合物 
①氮元素; ②最简单的有机物;
③三个硫酸根离子; ④二氧化氯中氯元素的化合价。
A. 熟石灰 B. 石墨 C. 纯碱 D. 碳酸钙
①可作干电池电极的是; ②可用作补钙剂的是;
③用于中和土壤酸性的是; ④厨房中用于洗涤油污中的“碱”是。
①铁在氧气中燃烧:; ②高锰酸钾受热分解:;
③绿色植物的光合作用:
④二氧化氮和铜加热生成氧化铜和一种空气中的主要气体:。
①草莓大棚所用的塑料薄膜属于(填序号,下同);
A. 有机合成材料 B. 无机材料 C. 复合材料
②用发酵后的牛奶做肥料,种出的草莓又大又甜。发酵后的牛奶含有C,H,O和N等元素。浇“牛奶”相当于施加了。
A. 氮肥 B. 磷肥 C. 钾肥 D. 复合肥
①工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为;
②小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图所示的两个实验:
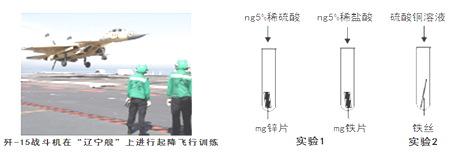
Ⅰ.实验1中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不合理,理由是;
Ⅱ.通过实验2,可证明铁的活动性比铜强,反应的化学方程式是。

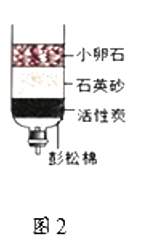
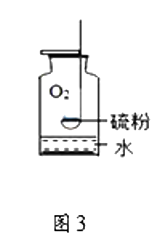
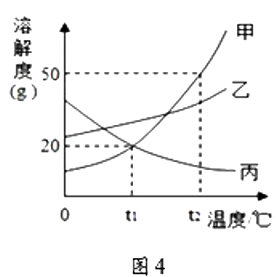
①t1℃时,丙物质的溶解度为;
②t2℃ 时将30g甲物质加入到50g水中,充分溶解,所得溶液的质量为 g;
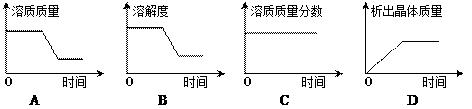
③将t2℃时乙的不饱和溶液逐渐冷却至t1℃,下图中有关量随时间变化的趋势一定错误的是。
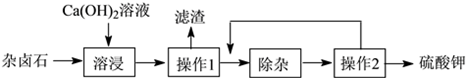
已知:
物质 | CaSO4 | K2SO4 | Mg(OH)2 |
溶解度/g(25℃) | 0.28 | 11.1 | 0.00084 |
a. K2CO3 b. Na2CO3 c. 稀硫酸 d. 稀盐酸
a. 30℃的水 b. 饱和的硫酸钠溶液 c.饱和的硫酸钾溶液
实验一:实验室中可用KClO3在MnO2催化下受热分解制取氧气,完全反应后对混合物进行分离回收并进行相关性质实验,实验操作如图所示(MnO2难溶于水)。

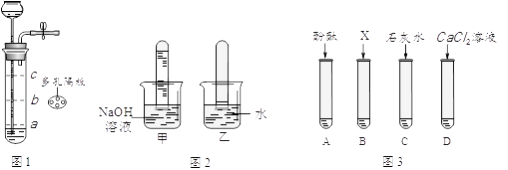
①若用图1装置制取二氧化碳气体,为了便于控制反应随时发生和停止,多孔隔板合适的位置是处(选填“a”、“b”或“c”),不适宜用作多孔隔板的材料是。
A.铁 B.塑料 C.铜片 D.石墨
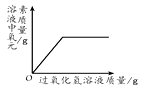
②用图1装置制取并收集两试管CO2气体,分别倒扣入图2盛有等体积NaOH溶液和水的烧杯中,该组对比实验产生的现象说明。
③为了进一步探究CO2与NaOH溶液是否发生反应,取图2甲烧杯实验后的溶液于图3(A~D)四支试管中,分别滴入四种不同类别的试剂,B中加入的是。四种方案中不合理的是,理由是。
【制取MgCO3·3H2O】工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO3·3H2O的方法如下:

图1 获取MgCO3·3H2O的工艺流程
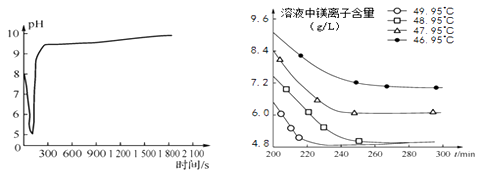
图2沉淀过程的pH变化 图3不同温度下溶液中镁离子含量随时间的变化
MgCl2+CO2+2NaOH+2H2O =MgCO3·3H2O↓+2
a. 向卤水中滴加NaOH溶液,同时通入CO2
b. 向NaOH溶液中滴加卤水,同时通入CO2
c. 向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d. 向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
不同反应温度下的水合碳酸镁
温度(℃) | 产物 |
46.95 | MgCO3·3H2O |
47.95 | MgCO3·3H2O |
48.95 | MgCO3·3H2O |
49.95 | Mg5(OH)2(CO3)4·4H2O |
则沉淀过程选择的温度为,理由是。
利用下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO3·3H2O的纯度。

依据实验过程回答下列问题:
实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有。
a.在加入硫酸之前,应排净装置内的CO2气体
b.为了缩短实验时间,快速滴加硫酸
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在C装置左侧导管末端增添多孔球泡