 B .
B .  C .
C .  D .
D . 
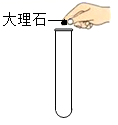 C . 量取液体
C . 量取液体 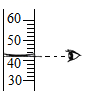 D . 加热液体
D . 加热液体 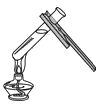

选项 | 异常现象 | 分析 |
A | 实验室制取氧气时,收集不到O2 | 装置漏气 |
B | 用量筒量取液体时,所得液体偏多 | 仰视读数 |
C | 红磷燃烧测量空气中氧气含量,偏大 | 红磷太多 |
D | 给试管里的固体加热时,试管炸裂 | 试管口未略向下倾斜 |
①保护青山绿水;②就地焚烧垃圾;③减少燃煤使用; ④燃放烟花爆竹; ⑤推广使用电动公交车
 B .
B .  C .
C .  D .
D . 
氦气在空气中含量甚微。通常它是一种无色无味的气体,它的密度为0.1785克/升,大约为氢气的2倍,空气的七分之一,氦气的化学性质稳定,不易燃不易爆,使用十分安全。在标准大气压下,液氦的沸点是-268.9℃,固态氦的熔点为-272.3℃,它与“绝对零度”(-273.15℃)仅一步之遥,因此,液氦可称得上是“世界上最冷的液体”了。液氦的这种超低温特性,在生产与科学研究上有很重要的应用。(已知空气密度为1.293克/升)

实验步骤 | 实验现象 | 结论 |
1.取一支蜡烛,用小刀切下一小块,把它放入水中。 | 蜡烛浮在水面上 | 物理性质: |
2.点燃蜡烛,在火焰上方罩一个冷而干燥的烧杯。 | 证明生成 | |
3.迅速把烧杯倒转过来,向烧杯内注入少量澄清石灰水,振荡。 | 证明生成 |

(提出问题)氧化铜能否作为过氧化氢分解的催化剂?
(进行实验)
①如图连接装置,加入20毫升10%过氧化氢溶液,收集氧气。
②向试管中加入二氧化锰粉末,加入10%的过氧化氢,观察现象并记录相关数据如表。
③清洗并干燥装置,换用氧化铜粉末重复步骤②,相关数据记录表中
步骤 | 物质 | 质量/g | 10%过氧化氢体积/mL | 集满一瓶氧气所用时间/s |
1 | / | / | 20 | 630 |
2 | 二氧化锰 | 0.5 | 20 | 25 |
3 | 氧化铜 | …… | 20 | 38 |
④将反应结束后剩余氧化铜固体进行过滤、洗涤、干燥并 (填写操作名称),证明氧化铜在反应前后质量未发生变化;
⑤将上一步所得固体加入少量等浓度的过氧化氢溶液,伸入带火星的木条,观察木条复燃 ,证明氧化铜的 在反应前后未发生变化。
试题篮
0