 B .
B .  C .
C .  D .
D . 


选项 | 实验目的 | 实验操作 |
A | 除去CO2中的CO | 点燃 |
B | 鉴别氧化铜和二氧化锰 | 观察颜色 |
C | 除去铜粉中的少量铁粉 | 加入足量稀硫酸,过滤 |
D | 除去FeCl2溶液中的CuCl2 | 加入足量的锌粉,过滤 |

 足量红磷在密闭容器中燃烧 B .
足量红磷在密闭容器中燃烧 B . 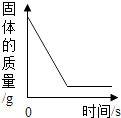 将铜片加入一定量的硝酸银溶液中 C .
将铜片加入一定量的硝酸银溶液中 C . 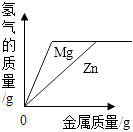 向两份完全相同的稀盐酸中分别加入锌粉、镁粉 D .
向两份完全相同的稀盐酸中分别加入锌粉、镁粉 D . 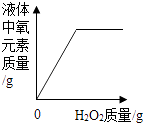 向盛有一定量MnO2的烧杯中加入H2O2溶液
向盛有一定量MnO2的烧杯中加入H2O2溶液 ①2个氮原子.②硫酸根离子.③2个氧分子.


①能燃烧的是(填“a”、“b”或“c”处),该处燃着的磷会很快熄灭,原因可能是(填序号).
A.温度降低 B.氧气耗尽 C.试管内产生CO2气体
②管口的小气球可以防止(填化学式)进入空气污染环境.
③比较试验a和c,可知白磷燃烧需要;比较实验a和b,可知物质燃烧需要.
①铸造硬币主要用到的都是材料.
②选择铸造硬币的材料不需要考虑的因素是(填序号)
A.金属的硬度; B.金属的导电性;
C.金属的耐腐蚀性; D.金属价格与硬币面值的吻合度
③铸造硬币涉及到Fe、Cu、Al、Ni(镍)四种金属,已知Ni能够发生如下反应:
Ni+H2SO4=H2↑+NiSO4 Fe+NiCl2=Ni+FeCl2
四种金属的活动性由强到弱的顺序是(用元素符号表示).

①试管尾部放一团湿棉花的目的是.
②如图所示,有肥皂泡飘到空中,用燃着的木条靠近肥皂泡,有爆鸣声.说明生成的气体是.
③充分反应后,试管中剩余固体成分可能是Fe2O3或Fe3O4中的一种,利用物理性质,鉴别的方法是.

①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物.写出反应的化学方程式.
②从图中分析得出的下列结论中,正确的是(填序号)
A.该技术符合低碳经济的理念
B.水生成氢气的过程中所用的催化剂一定是二氧化锰
C.该技术有助于缓解全球面临的能源危机

①;②.
上述装置改进后,请继续回答下列问题.
【查阅资料】
①在本实验中为了保证实验成功,通过碳的质量是要过量的.
②被还原出来的铜在温度较高时很容易与空气中的氧气反应生成氧化铜.
③氮气不与碳、氧化铜产生反应,可用来隔绝空气(氧气).
根据质量守恒定律可知,产生的气体有三种情况
①全部是CO2 ②全部是CO ③;
若猜想②成立,木炭还原氧化铜反应的化学方程式为:.
【实验】

操作步骤及实验现象 | 简答 |
①称取0.8g氧化铜与0.2g碳粉均匀混合,放入重25g的玻璃管中,同时称得广口瓶和石灰水的总质量为500g,按图中装置连接 | / |
②加热前,先通一段时间纯净、干燥的氮气 | 其目的是 |
③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊 | 澄清石灰水变浑浊的方程式为 |
④完全反应后,冷却至室温,称得玻璃管和固体总质量为25.5g | |
⑤称得广口瓶和石灰水的总质量为500.4g |
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 2.68 | 2.52 | 2.04 | 2.04 |