 酒精灯 B .
酒精灯 B .  烧杯 C .
烧杯 C .  漏斗 D .
漏斗 D . 
序号 | 物质 | 试剂及操作 |
A | KCl溶液(K2CO3) | 加入适量的稀盐酸至无气体产生 |
B | Na2SO4溶液(H2SO4) | 加入适量的氢氧化钡溶液、过滤 |
C | Fe( Cu) | 过量稀硫酸、过滤 |
D | MnO2粉末(KCl) | 加入适量的水,溶解、过滤、蒸发、结晶 |
①汽油 ②洗洁精

①写出反应的化学方程式:。
②A装置用分液漏斗加液,与用长颈漏斗加液比较,其优点是。
③从B装置中取出收集满CO2气体集气瓶的操作是。

①打开止水夹后观察到的现象是。
②反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有。
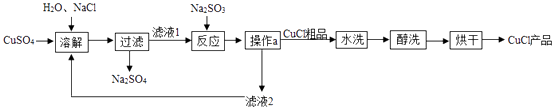

Ⅰ.对于碘化钾变质的原理,有两种不同的反应:
甲:4 KI+O2 +2CO2= 2K2CO3 +2I2 乙:4KI+ O2 +2H2O=4KOH +2I2
Ⅱ. KOH与NaOH两者的化学性质相似。为探究碘化钾变质原理的合理性,进行以下实验。
【实验过程】
[实验1]取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
据此现象,可得出的结论是。

查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。化学兴趣小组据此改进实验,很快观察到固体泛黄的现象。
简述化学兴趣小组改进实验的具体措施:。
根据上述实验,化学兴趣小组得出结论:碘化钾固体泛黄变质是碘化钾与共同作用的结果。
试题篮
0